विषय-सूचि
ऊष्मागतिकी का तृतीय नियम (third law of thermodynamics definition in hindi)
परिभाषा: किसी भी परफेक्ट क्रिस्टल की एंट्रोपी पूर्ण तापमान (एब्सोल्यूट टेम्परेचर, 0 Kelvin) पर जीरो (0) होती है।
यह दोनो ही आवश्यकताएँ, परफेक्ट क्रिस्टल तथा 0 K तापमान होना ज़रूरी है। यदि तापमान 0 K से अधिक हुआ, तो उस वस्तु के अणु थर्मल ऊर्जा के कारण हिलते रहेंगे, तथा उसमें कुछ थर्मल ऊर्जा भी शेष रहेगी, जिस कारण एंट्रोपी 0 से अधिक होगी।
और यदि वह वस्तु परफेक्ट क्रिस्टल (जिसके सारे अणु एक तय तरीके में ही हैं तथा एक समान हैं) ना होकर अमोरफस (अनाकार) हुई, जिसके अणु किसी भी तरह लगे हों, जैसे कांच, तो उसमे कुछ ऊर्जा शेष रह जाती है और एंट्रोपी जीरो नहीं होती।
अवशिष्ट एंट्रोपी (Residual entropy in hindi)
असल जीवन में 0 K प्राप्त करना अभी तक संभव नहीं हो पाया है। ऐसा केवल आदर्श परिस्तिथियों में किया जा सकता है। अपितु हम उसके निकट अवश्य पहुँच चुके हैं।
किंतु पूर्णतः 0 K प्राप्त न होने के कारण उस वस्तु में उसकी न्यूनतम ऊर्जा से अधिक ऊर्जा बच जाती है। साथ ही कुछ एंट्रोपी भी शेष रह जाती है, जिसे हम अवशिष्ट एंट्रोपी कहते हैं।
0 K की अप्राप्यता (Un-attainability of 0 K in hindi)
यह भी बताया गया, की चूँकि 0 K तक जाने के लिए अनंत बार छोटे-छोटे कदम लेने होंगे, व्यवहारिक रूप से ऐसा कर पाना असंभव है।
यदि यह संभव होता, तो यह ऊष्मप्रवैगिकी के दूसरा कानून का उलंघन होता। 0 K पर भी ऊष्मा सिंक होता, और ऐसे यंत्र का निर्माण किया जा सकता था, जो 100 प्रतिशत कुशल (efficient) होता।
ऊष्मागतिकी के तीसरे नियम के उपयोग (Application of 3rd law of thermodynamics in hindi)
इस कानून का सबसे महत्वपूर्ण उपयोग यह है कि इससे हम एंट्रोपी में बदलाव की जगह किसी भी तापमान T पर सीधे एंट्रोपी ही निकाल सकते हैं। इसमे उस वस्तु की ताप क्षमता ( हीट कैपेसिटी ‘C’ ) का प्रयोग करते हैं।
यदि S० 0 Kelvin पर एंट्रोपी है और S कोई तापमान T Kelvin पर, तो
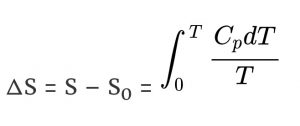
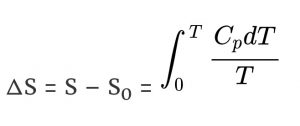
तीसरा कानून कहता है कि S० = 0 जब T = 0 K, इसलिए –
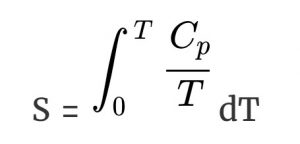
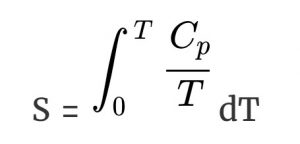
S का मूल्य पता करने के लिए हम Cp/T v/s T का ग्राफ बना कर, वक्र ( कर्व ) के नीचे का क्षेत्र ( एरिया ) निकालते हैं। तापमान T पर इसे और सरलीकृत ढंग से व्यक्त करने हेतु हम इस समीकरण ( इक्वेशन ) को इस प्रकार लिखते हैं –
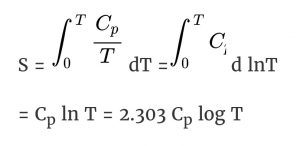
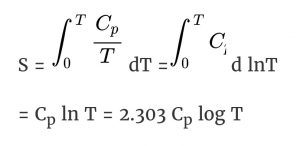
जहाँ Cp हीट कपैसिटी है स्थिर दबाव (कांस्टेंट प्रेशर) पर जिसका मूल्य 0 से T Kelvin के बीच स्थिर रहता है।
इस लेख से सम्बंधित यदि आपका कोई सवाल या सुझाव है, तो आप उसे नीचे कमेंट में लिख सकते हैं।
सम्बंधित लेख:
- ऊष्मागतिकी का पहला नियम (first law of thermodynamics)
- ऊष्मागतिकी का दूसरा नियम (second law of thermodynamics)

0 k Tak jaane ke liye anant kadam Kyu lene padte Hain is Tak pahuch paana asambhav Kyu kahaa Gaya hai?