विषय-सूचि
हैलोजन की परिभाषा (halogens definition in hindi)
परिभाषा: ग्रीक भाषा में हैलोजन का अभिप्राय है- hals-sea salt; gennao- producer।
आवर्त सारणी के वर्ग 17 में स्थित कुल पाँच तत्वों फ्लोरीन (F),क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I), एस्टेटीन (As) को सामान्यता हैलोजन कहते हैं क्योंकि इन सभी तत्वों के लवण समुद्री जल में बहुतायत से पाये जाते हैं। इनमें एक एस्टेटीन(As) रेडियो एक्टिव तत्व है।
हैलोजन की उपस्थिति (occurrence of halogens in hindi):
उचित क्रियाशीलता के कारण यह मुक्त अवस्था में नहीं पाए जाते हैं। संयुक्त अवस्था में यह भू पर्पटी तथा समुद्री जल में पाए जाते हैं।
मुख्य हैलाइड खनिज फ्लोरसपार, टोपाज, क्रायोलाइट, सिल्वीन, कार्नेलाइट आदि हैं।
हैलोजन का इलेक्ट्रानिक विन्यास (electronic configuration of halogens in hindi):
इस वर्ग के सभी तत्वों के बाहरी कोश में 7 इलेक्ट्रॉन होते हैं। इनका इलेक्ट्रोनिक विन्यास निम्न है –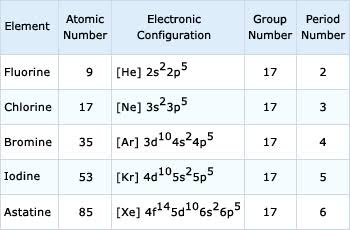
हैलोजन की भौतिक अवस्था (physical state of halogens in hindi):
- सभी हैलोजन तत्व अध्रुवीय,सह संयोजक, द्विपरमाणविक अणुओं के रूप में पाये जाते है। जैसे- F2
- यह अणु आपस में दुर्बल वाण्डरवाल्स बलों द्वारा जुड़े रहते हैं। परमाणु आकार तथा अणु भार बढ़ने के साथ-साथ इन बलों का मान भी बढ़ता है। अतः F2, Cl2, गैस; Br2 द्रव तथा I2 ठोस अवस्था में पायी जाती है।
- फ्लोरीन तथा क्लोरीन हरे पीले रंग की गैसें हैं ,ब्रोमीन लाल भूरे रंग का वाष्पशील द्रव है जबकि आयोडीन बैंगनी रंग का ठोस है।
हैलोजन के सामान्य गुणधर्म (General properties of halogens in hindi):
- हैलोजन तत्वों के वर्ग में ऊपर से नीचे जाने पर नाभिकीय आवेश घटने के कारण परमाणु तथा आयनिक त्रिज्या का मान बढ़ता है जबकि आयनन उर्जा का मान वर्ग में ऊपर से नीचे जाने पर घटता है।
- हैलोजनों की इलेक्ट्रॉन बंधुता वर्ग में नीचे की ओर जाने पर पहले क्लोरीन तक बढ़ती है फिर घटती है। ज्ञात तत्वों में क्लोरीन की इलेक्ट्रान बंधुता सबसे ज्यादा होती है। इलेक्ट्रॉन बंधुता का क्रम- Cl>Fl>Br>I
- विद्युत ऋणात्मकता का मान वर्ग में ऊपर से नीचे जाने पर घटता है। ज्ञात तत्वों में F की विद्युत ऋणात्मकता सबसे ज्यादा होती है।
- हैलोजन परिवार के सभी तत्व अधातु है। वर्ग में ऊपर से नीचे जाने पर धात्विक गुण बढ़ता है इसी कारण आयोडीन में कुछ धात्विक गुण पाए जाते हैं।
- हैलोजन अणु अध्रुवीय होते हैं।अतः ये ध्रुवीय विलायको में अच्छी प्रकार से विलेय नहीं होते हैं।
- सभी हैलोजन एक संयोजक या द्विसंयोजक धातुओं से क्रिया करके सामान्यतः आयनिक हैलाइड बनाते हैं।
- सभी हैलोजन अधातुओं से क्रिया करके सामान्यतः सह-संयोजक हैलाइड बनाते हैं।
- सभी हैलोजन हाइड्रोजन से क्रिया करके सामान्यतः सह-संयोजक हाइड्रोजन हैलाइड बनाते हैं।
फ्लोरीन का असंगत व्यवहार (abnormal behavior of fluorine in hindi):
फ्लोरीन के गुण इसके वर्ग के अन्य तत्वों से भिन्न होते हैं। इसके असंगत व्यवहार का कारण उसका छोटा आकार, उच्च विद्युत ऋणात्मकता, निम्न वियोजन ऊर्जा तथा d कक्षकों अनुपस्थिति का होना है।
निम्न बिदुंओ से इसके असंगत व्यवहार की पुष्टि होती है-
- फ्लोरीन की अधिकतम विद्युत ऋणात्मकता होने के कारण यह केवल -1 ऑक्सीकरण अवस्था प्रदर्शित करती है जबकि अन्य हैलोजन -1 से +7 तक ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
- HCl ,HBr तथा HI की अपेक्षा HF दुर्बलतम अम्ल है।
- d कक्षको की अनुपस्थिति के कारण फ्लोरीन केवल 1 सहसंयोजकता प्रदर्शित करता है।
- HCl ,HBr तथा HI एक क्षारीय (monobasic) जबकि HF द्विक्षारीय (diabasic) है।
- फ्लोरीन में अधिकतम आयनिक गुण होते हैं।
क्लोरीन (Chlorine in hindi):
- इसकी खोज शीले (Sheele) ने 1774 मे की थी।
- प्रयोगशाला में क्लोरीन का निर्माण मैंगनीज डाइऑक्साइड को सांन्द्र HCl के साथ गर्म करके किया जाता है। 4HCl (aq) + MnO2(s) → 2H2O(l) + MnCl2(aq) + Cl2(g)
- औद्योगिक स्तर पर क्लोरीन का निर्माण डीकन विधि तथा ब्राइन के विद्युत अपघटन द्वारा किया जाता है।
- यह तीखी (pungent),गंध की विषैली तथा दम घोटने वाली गैस है।
- नमी की उपस्थिति मे यह गैस विरंजक (Bleaching) का कार्य करती है। यह रंगीन फूल पत्तियों, रंगीन कपड़ो तथा अन्य कई रंगीन वस्तुओं का रंग उड़ा देती है।
क्लोरीन के उपयोग (uses of chlorine in hindi)
- ऑक्सीकारक के रुप में।
- विरंजक पाउडर (Bleaching powder) के निर्माण में।
- कीटनाशक के रुप में।
- रोगाणुनाशक के रुप में।
- DDT, गैमेक्सीन,क्लोरोफार्म,प्लास्टिक आदि महत्वपूर्ण रसायन बनाने में।
ब्रोमीन (Bromine in hindi):
- सर्वप्रथम बैलार्ड (Balard) ने 1811 में इसकी खोज की।
- प्रयोगशाला में यह गैस मैगनीज डाइऑक्साइड तथा KBr मिश्रण को सांद्र सलफ्यूरिक एसिड के साथ गर्म करके प्राप्त की जाती है।
- ब्रोमीन गहरे लाल रंग का भारी द्रव है। सामान्य ताप पर इसमें से लाल रंग का तीव्र गंध का विषैले धुआं उठता रहता है। इस के संपर्क में आने पर त्वचा गल जाती है तथा घाव हो जाते हैं।
- ब्रोमीन स्टार्च विलयन में घुलकर नारंगी पीला रंग देती है।
ब्रोमिन के उपयोग (uses of bromine in hindi):
- प्रयोगशाला में अभिकर्मक के रूप में।
- ऑक्सीकारक के रूप में।
- विरंजक के रूप में।
- रंजक पदार्थ (Dye stuff) बनाने में।
- जीवाणु नाशक के रूप में।
- ब्रोमीन जल कार्बनिक यौगिकों की असंतृप्त प्रकृति का परीक्षण करने में।
आयोडीन (Iodine in hindi):
- सर्व प्रथम कोर्टोइस (Courtois) ने 1811 में आयोडीन की खोज।
- प्रयोगशाला में यह गैस मैगनीज डाइऑक्साइड तथा KI मिश्रण को सांद्र सलफ्यूरिक एसिड के साथ गर्म करके प्राप्त कीजाती है।
- बैंगनी रंग की वाष्प होने के कारण ही इसे आयोडीन (Gr; ioeides = बैंगनी) कहा जाता है।
- आयोडीन कार्बनिक यौगिको जैसे- बेंजीन, क्लोरोफॉर्म, कार्बन टेट्रा क्लोराइड आदि में घुलकर बैगनी रंग का विलयन बनाती है।
आयोडीन के उपयोग (uses of iodine in hindi):
- प्रयोगशाला में आयोडोफार्म परीक्षण करने के लिए।
- आयोडीन के यौगिक औषधियों के रुप में प्रयोग किये जाते हैं।
- ऑक्सीकारक के रुप में।
- आयतनात्मक विश्लेषण में।
- आयोडीन का कोलॉयडी विलयन ‘घेंघा’ रोग के इलाज मे प्रयुक्त होता है।
इस विषय से सम्बंधित यदि आपका कोई सवाल या सुझाव है, तो आप उसे नीचे कमेंट में लिख सकते हैं।

Chorine oxikarak ki tarah kaise kaam karta h?
Details me bataye
हैलोजन का इलेक्ट्रॉनिक कॉन्फ़िगरेशन क्याi होता है? spdf फॉर्म में.
Halogen rangeen ku hota hai
Kya halogen parivar ke sabhi tatv adhaatu hote Hain? Yaa fir in me see koi dhaatu bhi hota hai? Isme kitne tatv hote Hain?