विषय-सूचि
यौगिक में परमाणु तथा पदार्थ में अणु को आपस में बांधे रखने के लिए जो कारक अथवा बल उत्तरदायी होते हैं, बंध (Bonds) कहलाते हैं तथा यह प्रक्रिया बंधन (Bonding) कहलाती है।
पॉलिंग के अनुसार,” एक रासायनिक बंध दो परमाणुओं के बीच लगने वाला वह बंधन बल है जिसकी शक्ति के कारण बना परमाणुओं का झुंड इतना स्थायी होता है कि वह स्वतंत्र इकाई (अणु) माना जा सके” सरल अर्थों में अणु में उपस्थित परमाणुओं के बीच लगने वाला आकर्षण बल बंध कहलाता है तथा किसी अणु मे परमाणु जितने रासायनिक बंध बनाता है वह उसकी संयोजकता (valancy) कहलाती है।
रासायनिक बंध बनने के कारण (Causes of Chemical Bonding in hindi):
1. लुईस अष्टक नियम (Lewis octet Rule in hindi):
इस सिद्धांत के अनुसार, प्रत्येक तत्व अपने संयोजी कोश (valance shell) में 8 इलेक्ट्रॉन प्राप्त करके अधिक स्थायित्व अर्थात निकटतम अक्रिय गैस का विन्यास (configuration) प्राप्त करनेे की प्रवत्ति रखता है जिस कारण यह बंध बनाता है।
2. स्थितिज ऊर्जा घटाने की प्रवृति (Tendency to lower potential energy):
ब्रह्माण्ड में उपस्थित प्रत्येक System अपने स्थितिज ऊर्जा को कम करके अधिक स्थायी होने की प्रवृति रखता है। यह पाया गया है कि बंध निर्माण में परमाणुओं की स्थितिज ऊर्जा घट जाती है अर्थात बन्धित परमाणु (Bonded atom), आबंधित परमाणु की तुलना में अधिक स्थाई होता है क्योंकि इसकी ऊर्जा कम होती है।
ऊर्जा में होने वाली वाली यह.कमी बंध निर्माण के कारण होती है तथा इस प्रक्रिया में मुक्त होने वाली ऊर्जा बंधन ऊर्जा (Bond energy) कहलाती है।
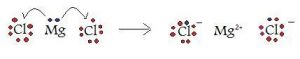
आयनिक बंध अथवा विद्युत संयोजी बंध (Ionic Bond or electrovalent Bond in hindi):
1. आयनिक बंध की व्याख्या सर्वप्रथम कोसल ने की थी।
2. परमाणुओं के मध्य इलेक्ट्रॉनों के पूर्ण स्थानांतरण (transfer) से बनने वाला बंध आयनिक बंध कहलाता है।
3. विद्युत संयोजी बंध के बनने में किसी परमाणु द्वारा ग्रहण अथवा त्याग किए गए इलेक्ट्रॉनों की संख्या उसकी विद्युत संयोजकता को प्रदर्शित करती है तथा स्थानांतरित इलेक्ट्रॉनों की संख्या इतनी होती है कि दोनों परमाणु अपने निकटतम अक्रिय गैस का विन्यास प्राप्त कर लेते हैं।
4. विद्युत संयोजी बंध सदैव दो भिन्न भिन्न परमाणुओं के मध्य ही बनता है।
उदाहरण:

आयनिक बंध बनाने के लिए आवश्यक स्थितियां (conditions for forming Ionic Bond in hindi):
1. धनायन में परिवर्तित होने वाले परमाणु की आयनन ऊर्जा (Ionization energy) जितनी कम होती है उससे आयनिक बंध बनने मे उतनी ही सुगमता होती है।
2. ऋण आयन में परिवर्तित होने वाले परमाणु की परमाणु की इलेक्ट्रान बंधुता (Election affinity) जितनी अधिक होती है वह उतनी ही आसानी से आयनिक बंध बना सकता है
विद्युत संयोजी यौगिकों की विशेषता (Characteristics of electrovalent Bond in hindi):
- ये क्रिस्टलीय ठोस होते हैं जिनमें आयन एक निश्चित 3-D विन्यास में जुड़े रहते हैं।
- प्रत्येक क्रिस्टल में आयनों की संख्या निश्चित होती है संख्या निश्चित होती है। यह आयन प्रबल बलों द्वारा बंधे होते हैं जिस कारण यह गति करने के लिए स्वतंत्र नहीं होते हैं।
- इनके गलनांक तथा क्वथनांक उच्च होते हैं।
- विद्युत संयोजी यौगिक ध्रुवीय विलायक (polar solvent) में विलेय होते हैं जबकि अध्रुवीय विलायक में अविलेय होते हैं।
- ठोस अवस्था में आयनिक यौगिक विद्युत के कुचालक होते हैं जबकि विलयन में इनके आयन गति कर सकते हैं अतः विलयन मे यह विद्युत के सुचालक होते हैं।
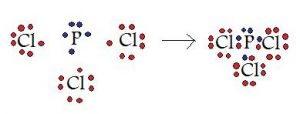
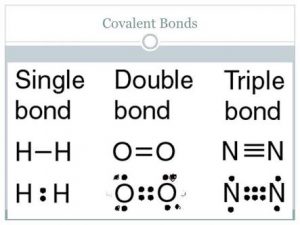
सहसंयोजी बंध (covalent Bond in hindi):
1. दो परमाणुओं के मध्य इलेक्ट्रॉनों की साझेदारी (sharing) से बना बंध सहसंयोजी बंध कहलाता है।
2. साझा किए गए इलेक्ट्रॉन युग्मों (election pair) की संख्या के आधार पर सहसंयोजी बंध एकल (single), द्वि (double) अथवा त्रिक (Triple) बंध होते हैं और इनमें क्रमशः 1,2 अथवा 3 इलेक्ट्रॉन युग्मों की साझेदारी होती है।
उदाहरण:
सहसंयोजी बंध बनने की स्थितियां (conditions required for covalent Bond in hindi)
- जब दो परमाणुओं के विद्युत ऋणात्मकता समान अथवा लगभग समान होती है तो उनके बीच सहसंयोजी बंध बनता है।
- जब दो अधातु आपस में संंयोग करते हैं तो उनके बीच सहसंयोजी बंध बनता है।
- वह यौगिक जिनमें संयोजकता 3 से अधिक होती है प्रायः सहसंयोजी ही होते हैं।
सहसंयोजी यौगिकों की विशेषता (characteristics of covalent compounds in hindi)
- सहसंयोजी यौगिकों में अणु दुर्बल वंडर वाल्स बलों जुड़े होते हैं इसी कारण यह तीनों अवस्थाओं में पाए जाते हैं।
- विद्युत संयोजी यौगिकों की तुलना में इनके गलनांक और क्वथनांक कम होते हैं
- सहसंयोजी बंध दैशिक होते हैं अतः यह यौगिक समावयवता (isomerism) प्रदर्शित करते हैं।
- अध्रुवीय सहसंयोजी यौगिक (non poler covalent compound) अध्रुवीय विलायक़ों में विलेय होते हैं जबकि ध्रुवीय विलायकों में अविलेय होते हैं।
उप-सहसंयोजी बंध (Co-ordinate Bond in hindi):
पार्किन्स के अनुसार ,उप सह संयोजी बंध एक विशेष प्रकार के सह संयोजी बंध है जिसमें साझे का इलेक्ट्रॉन युग्म केवल एक परमाणु प्रदान करता है।
वह परमाणु जो इलेक्ट्रॉन युग्म देता है उसे दाता (doner) कहते हैं तथा जो परमाणु इलेक्ट्रॉन लेता है वह ग्राही (accepter) कहलाता है। इस बंध के बनने के पश्चात दाता परमाणु पर आंशिक (partial) धनावेश जबकि ग्राही परमाणु पर आंशिक ऋणावेश आ जाता है अतः यह बंध अर्ध ध्रुवीय बंध (semi poler bond) भी कहलाता है।
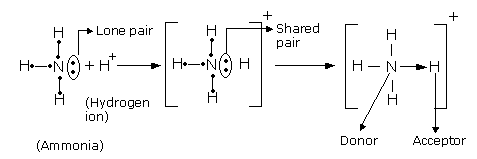
उपसहसंयोजक यौगिकों की विशेषता (Characteristics of co-ordinate compounds in hindi):
- यह ठोस द्रव और गैस तीनों प्रकार के हो सकते हैं।
- इन यौगिकों के गलनांक व क्वथनांक विद्युत संयोजी अथवा सहसंयोजी यौगिकों के बीच में होते हैं।
- ध्रुवीय विलायको जैसे जल में यह कम विलेय होते हैं जबकि कार्बनिक विलायक में यह विलेय होते हैं।
- यह विद्युत के कुचालक होते हैं हैं क्योंकि यह मुक्त आयन प्रदान नहीं कर सकते।
- उप सह संयोजी बंध के दिशात्मक (Directional) होने के कारण यह समावयवता प्रदर्शित करते हैं।
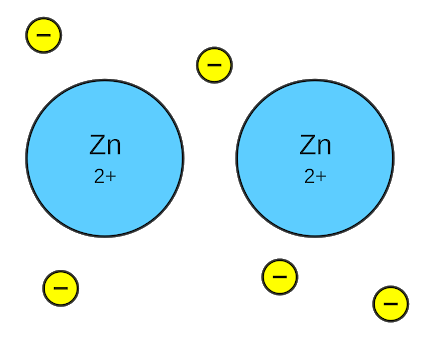
धात्विक बंध (metallic Bond in hindi):
धातुओं में परमाणुओं के बीच आयनिक अथवा सामान्य सहसंयोजी बंध नहीं होते हैं क्योंकि धातु में उपस्थित सभी परमाणु समान विद्युत ऋणात्मकता के होते हैं अतः उनके बीच आयनिक बंध नहीं बन सकता है। X किरणों द्वारा अध्ययन से यह ज्ञात हुआ है कि धातुओं में एक परमाणु 8 से 12 परमाणुओं द्वारा घिरा होता है।
इन परमाणुओं की बाह्य कक्षा में बहुत कम इलेक्ट्रॉन (1 से 3) होते हैं अतः एक परमाणु 12 परमाणुओं के साथ सह संयोजी बंध नहीं बना सकता। धातुओं में परमाणु आपस में एक विशेष प्रकार के बंध द्वारा जुड़े होते हैं जिन्हें धात्विक बंध कहते हैं।

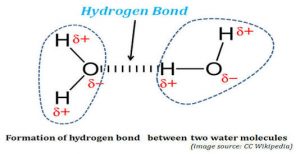
हाइड्रोजन बंध (hydrogen bonds in hindi)
इस प्रकार के बंध का विचार सर्वप्रथम लेटिमर तथा रोडबुश ने दिया। जब कोई हाइड्रोजन परमाणु किसी उच्च विद्युत ऋणी तत्व जैसे- F,O,N सहसंयोजी बंध से जुड़ा होता है तब बंध का इलेक्ट्रॉन युग्म विद्युत ऋणात्मक तत्व की ओर विस्थापित हो जाता है जिससे हाइड्रोजन पर आंशिक धनावेश व विद्युत ऋणी तत्व पर आंशिक ऋण आवेश आ जाता आ जाता जाता है।
ऐसा आंशिक धन आवेश युक्त हाइड्रोजन परमाणु एक तरफ F,O,N से तो सहसंयोजी बंध से जुड़ा होता है तथा दूसरी ओर किसी विद्युत ऋणात्मक परमाणु के साथ क्षीण विद्युत आकर्षण बल से जुड़ जाता है।इसे ही हाइड्रोजन बंध कहते हैं।

Ionic bonds or covalent bonds me Kya Kya differences hote h?
ionic bond m electron sharing poori tarah se hoti h jabki covalant bond m dono milkar bond formation karte h.
tendency to lower potential energy kaa matlab kya hotaa hai? iske kya uses hote hain?
Metallic bond kin kin do dhaatuon ke beech banta hai? Kya ye adhaatuo ke beech mein nahi ban sakta hai?
Mast laga study karke nice sir
मज़ा आ गया स्टडी कर के