विषय-सूचि
ऊष्मागतिकी के दुसरे नियम को समझने के लिए हमें पहले एन्ट्रापी के बारे में जानना होगा।
एन्ट्रापी क्या है? (what is entropy in hindi)
समय के साथ मैटर और ऊर्जा की गुणवत्ता कम होती जाती है। उपयोग करने योग्य ऊर्जा को अनिवार्य रूप से हम उत्पादन, विकास और मरम्मत के लिए खर्च करते हैं।
इस प्रकिया में वह ऊर्जा अब उपयोग के योग्य नहीं रहती। यानी उपयोगी ऊर्जा अनुपयोगी बन खोती जा रही है। एंट्रोपी इसी अनुपयोगी ऊर्जा के माप को कहते हैं ( किसी बंद अथवा पृथक सिस्टम में)।
अनुपयोगी ऊर्जा बढ़ने से एंट्रोपी भी बढ़ रही है।
एंट्रोपी का दिमागी चित्र बनाने की लिए हम उसे अनियमितता या बिना कायदे जैसा सोच सकते हैं। जितनी ज्यादा अनियमितता, उतनी ज़्यादा एंट्रोपी।
उदाहरण के लिए, एक गैस की एंट्रोपी उसी तत्व के ठोस रूप की एंट्रोपी से ज़्यादा होती है, क्योंकि गैस के अणु ज़्यादा अनियमित होते हैं।
ऊष्मागतिकी का दूसरा नियम (2nd law of thermodynamics in hindi)
पहला कानून यह तो बताता है कि कोई विशेष प्रक्रिया होगी या नहीं। परंतु वह ये बताने में असमर्थ है कि वो प्रक्रिया स्वाभाविक रूप से होगी, या किसी बाहरी सहायता की आवश्यकता है।
दूसरा कानून कहता है कि विश्व की एंट्रोपी निरंतर, स्वाभाविक रूप से बढ़ती रहती है। यह कभी कम नहीं होती। यानी अगर विश्व की एंट्रोपी को दो अलग – अलग समय पर नापा जाए, तो दूसरी बार वो सदा ज़्यादा ही मिलेगी।
आदर्श स्थितियों में ( जब प्रतिवर्ती प्रक्रिया हो ), दोनो समय समान एंट्रोपी मिलेगी, यानी उसमे कोई बदलाव नहीं होगा।
ऊष्मागतिकी के दुसरे नियम के निष्कर्ष (result of 2nd law of thermodynamics in hindi)
- ऊष्मा को पूर्ण रूप से वर्क (काम) मे कभी परिवर्तित नहीं किया जा सकता। ऊष्मा को वर्क में परिवर्तित करने की प्रक्रिया में कुछ ऊष्मा हमेशा ही बर्बाद हो जाती है। यह हीट इंजन में भी देखने मिलता है।
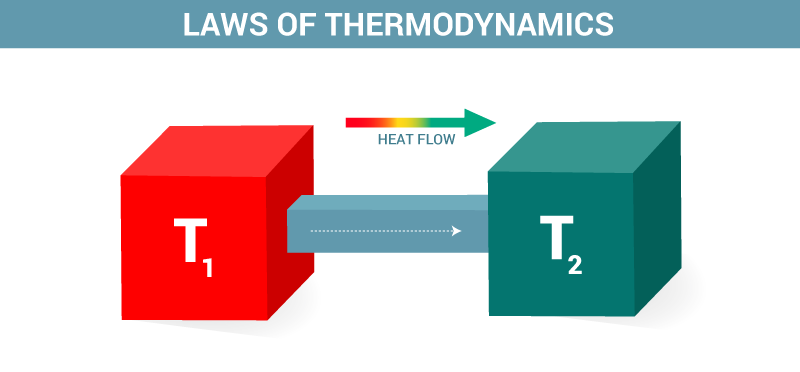
- ऐसे किसी यंत्र का निर्माण असंभव है जो ऊष्मा का एक चक्रीय प्रक्रिया द्वारा किसी शीतल वस्तु से गर्म वस्तु में स्थानांतरण करे। ऐसा करने हेतु किसी बाहरी बल का काम (वर्क) करना आवश्यक है। क्योंकि ऊष्मा अनायास केवल गर्म से शीतल वस्तु की ओर बहती है। यह रेफ्रीजिरेटर और हीट पंप में देखने मिलता है।
- स्वाभाविक रूप से होने वाली थर्मोडाइनैमिक्स की सारी प्रक्रियाएँ इर्रिवर्सिबल ( जिन्हें उल्टा न जा सके ) होती हैं।
एन्ट्रापी का दिशात्मक गुण (quality of entropy in hindi)
यदि किसी गैस को एक पात्र में रख दिया जाए, तो वह अनायास ही एक कोने में जाके सिकुड़ नहीं जाती। इसी तरह अगर कार्बन डाइऑक्साइड स्वयं ही कार्बन तथा ऑक्सीजन नहीं देगा। उलटे, मनुष्य सदा बुढ़ा ही होगा। वह पुनः जवान नहीं हो सकता।
ऐसे कई और उदाहरण यही संकेत करते हैं कि ये अनायास बदलाव एक ही दिशा में होते हैं। यह उसी दिशा की ओर होंगे जहाँ इनकी स्वछंदता (स्पौन्टैनिटी) बढ़ेगी।
और स्वछंदता बढ़ने से एंट्रोपी भी बढ़ती है, जिस कारण विश्व की एंट्रोपी बढ़ रही है।
ऊष्मागतिकी के दुसरे नियम का आशय (implication of 2nd law of thermodynamics in hindi)
उपयोग लायक ऊर्जा इस भाँति अनुपयोगी ऊर्जा में परिवतिर्त हो रही है, जिसे हम वापिस नहीं पा सकते। ऊर्जा केवल खो रही है। पुनः प्राप्त नहीं हो रही।
इसी तार्किक आधार पर हम यह निष्कर्ष करते हैं कि ब्रह्मांड सनातन नहीं है। यह एक दिन प्रारंभ हुआ था, जब इसकी एंट्रॉपी ज़ीरो (0) थी और इसी प्रकार इसका अंत भी निश्चित है।
इस लेख से सम्बंधित यदि आपका कोई सवाल या सुझाव है, तो आप उसे नीचे कमेंट में लिख सकते हैं।
सम्बंधित लेख:
- ऊष्मागतिकी का पहला नियम (first law of thermodynamics)
- ऊष्मागतिकी का तीसरा नियम (third law of thermodynamics)

Ushma ko poori tarah se work me convert katne ka Kya koi tareeka hai? Kya hum ise convert hone see ok sakte hain?
Karma engine se thoda bahot posible hai
Thanks a lot