विषय-सूचि
ताप रसायन की परिभाषा (definition of thermochemistry in hindi)
ताप रसायन (Thermochemistry) भौतिक रसायन (Chemistry) का वह भाग है जिसमें रासायनिक प्रक्रिया (chemical reaction) से सम्बंधित उष्ण ऊर्जा (Heat energy) और उसमें होने वाले परिवर्तन की पढ़ाई की जाती है।
यह प्रतिक्रिया के दौरान अभिकारक और उत्पाद मात्रा पता करने में सहायक है। यह ऊष्मप्रवैगिकी के नियमो पर आधारित है जोकि इस प्रकार है – ऊष्मा ऊर्जा का एक प्रकार है और इसे न तो तैयार किया जा सकता है और न नष्ट किया जा सकता है।
रासायनिक क्रियाओं में ऊर्जा से सम्बंधित जो बदलाव होते हैं, वे अणुओं (atoms) के बीच के स्थित बंध टूटने और नए बंध बनने के कारण होते हैं। अतः ताप रसायन के द्वारा अणुओं के बंध से सम्बंधित जानकारी मिलती है। ऊर्जा के कारण प्रक्रिया करने की क्षमता आती है।
हम सभी यह बात जानते हैं कि रासयनिक प्रक्रियां जब हो रही होती हैं, उनके साथ ऊर्जा बदलाव भी होता है। यह बदलाव अणुओं के विकास के रूप में होता है या उष्मा के अवशोषण के रूप में। रासायनिक प्रक्रिया के दौरान जो ऊर्जा प्रवाहित होती है, इसका कुछ भाग उष्ण, विद्युतीय या प्रकाश ऊर्जा के रूप में प्रवाहित हो जाती है। रासायनिक प्रक्रिया के दौरान ऊर्जा की मात्रा जो बनती है या सोख ली जाती है- उनकी मात्रा हमेशा बराबर रहती है।
ताप रसायन की प्रक्रिया में मानक अभिक्रिया उष्मा के ΔH स्थिर दाब को तापीय धारिता (enthalpy) कहते हैं। ऊष्मा उत्सर्जित प्रक्रियाओं में ΔH को ऋणात्मक चिह्न और ऊष्मा अवशोषित प्रक्रियाओं में ΔH को धनात्मक चिह्न द्वारा प्रदर्शित किया जाता है ।
ताप रसायन समीकरण एक तरीका है जिसके द्वारा उत्सर्जित अथवा अवशोषित ऊर्जा को एक रासायनिक समीकरण के रूप में व्यक्त किया जाता है। इसका उदाहरण इस प्रकार है:
जब निर्जल (anhydrous) कैल्शियम क्लोराइड के 1 मोल को 400 मोल के पानी में गलाते (dissolve) हैं, 78.60 kJ की ऊर्जा बनती है।
Cacl2 (s) + 400 H2O (l) —-> CaCl2 (400 H2O), ΔH = -78.60 kJ
कैलोरीमीटर (calorimeter in hindi)
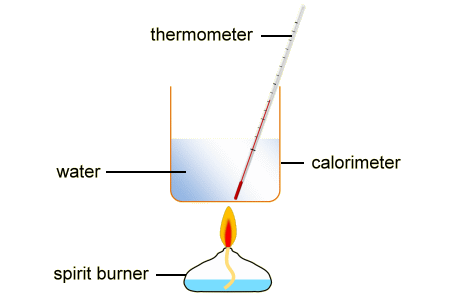

रासायनिक प्रक्रिया करते वक्त ऊष्मा की मात्रा में जो बदलाव होता है, उसकी मात्रा का माप लेने के लिए कैलोरीमीटर का उपयोग करते हैं। ये स्टेनलेस स्टील या सोने की परत वाले ताम्बे से ही बने होते।
अन्य धातुओं का उपयोग नहीं होता क्योंकि वे रासायनिक पदार्थों के साथ परिवर्तित हो सकते हैं। इन प्रक्रियाओं को थर्मस फ्लास्क में लगे बीकर या स्टायरोफोम कप में भी प्रदर्शित किया जा सकता है। जब ऊष्मा के माप में बदलाव होता है, तब कैलोरीमीटर भी कुछ ऊष्मा सोख लेता है।
ताप रसायन की प्रणाली (thermochemistry system in hindi)
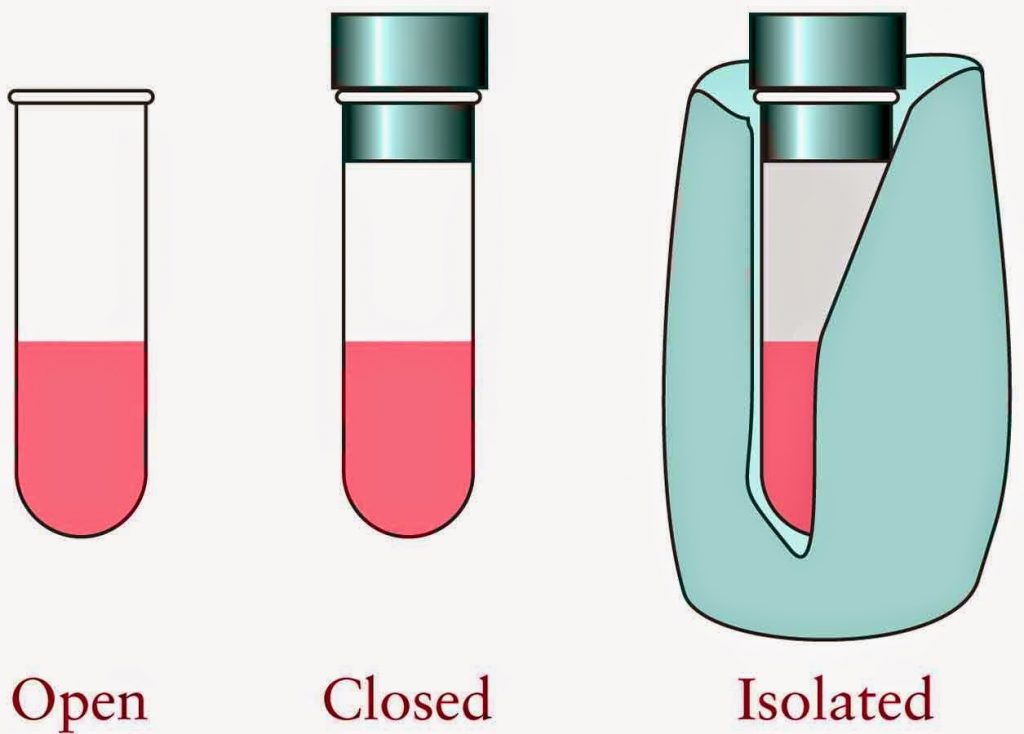

प्रणाली या निकाय ब्रह्माण्ड का वह भाग है जिसके बारे में पढ़ा जाता है। यह पदार्थ और ऊर्जा का एक सेट है। उदहारण के लिए अगर किसी जार में प्रयोग चल रहा है तो जार के बाहर का सबकुछ एक प्रणाली है।
इसके बाहरी क्षेत्र को वातावरण (surrounding) माना गया है। प्रणालियों के कुछ प्रकार हैं:
- खुली हुई प्रणाली (Open System) जो वातावरण के साथ पदार्थ और ऊर्जा दोनों की अदला-बदली कर सकते है।
- अंदरूनी प्रणाली (Closed System) में वातावरण के साथ पदार्थो की अदला-बदली नहीं हो सकता, लेकिन ऊर्जा का आदान प्रदान होता है।
- विलगित निकाय (Isolated system) में वातावरण के साथ न पदार्थों का आदान प्रदान होता है और न ही ऊर्जा का।
- थर्मल विलगित निकाय में यांत्रिक कार्य का आदान प्रदान हो सकता है, किन्तु ऊर्जा या पदार्थ का नहीं हो सकता।
ताप रसायन की प्रक्रिया (thermochemistry process in hindi)
जब प्रणाली किसी प्रक्रिया से होकर गुजरती है, तब उसके गुणों में बदलाव आने लगता है। ये आकlर (state) के परिवर्तन से सम्बंधित हैं। जब प्रणाली का दबाव स्थायी रहता है, तब समदाबिक प्रकरण (isothermal process) होता है।
जब प्रणाली का तापमान स्थायी होता है, तब समतापी (isothermal) प्रक्रम होता है। अगर उष्णता का आदान प्रदान नहीं होता तो उस प्रक्रिया को स्थिरोष्म (adiabatic) प्रक्रिया कहते हैं।
लेपलेस का नियम (laplace law in hindi)
लेपलेक और लेवायाइज़ीयर ने मिलकर यह नियम 1780 में दिया था। यह इस प्रकार है – किसी प्रतिक्रिया की तापीय धारिता (enthalpy) वही रहती है किन्तु उत्क्रमणीय प्रतिक्रिया के संकेत (mathematical sign) का उल्टा रहता है।
उदाहरण:
C(s) + 2S(s) → CS2(l) ΔH = -92.0kJ
CS2(l) → C(s) + 2S(s) ΔH = +92.0kJ
एक प्रक्रिया का तापीय धारिता संकेत दूसरे के मुकाबले उल्टा हैl
हेस का नियम (hess law in hindi)
सन 1840 में हेस ने ऊष्मा में सम्बंधित एक कानून दिया था जोकि इस प्रकार है – किसी एक प्रक्रिया के दौरान उष्मा की मात्रा में जो बदलाव आता है वह हमेशा एक सामान रहता है, चाहे वह प्रक्रिया एक बार में हो या दूसरी बार में । इस नियम का उदहारण इस प्रकार है:
S(s) + O2(g) → SO2(g) ΔH = -296.9 kJ
SO2(g) → S(s) + O2(g) ΔH = +296.9 kJ
दोनों प्रक्रियाओं में ऊर्जा की मात्रा बराबर है।
किसी केमिकल प्रक्रिया के दौरान जो ऊर्जा बनती है या सोख ली जाती है, वह ऊर्जा के प्रारंभिक अभिकारकों और अंतिम उत्पादों पर निर्भर करती है।
ऊष्मा प्रक्रिया के पथ पर या किस प्रकार से बदलाव आया है- इस बात पर निर्भर नहीं करती।
ताप रसायन का उपयोग (application and use of thermochemistry in hindi)
- योगिक जिनका ऊष्मा उत्पादन वर्णमिति (calorimetric) के माध्यम से मापित नहीं किया जा सकता क्योंकि वे अपने तत्वों द्वारा संश्लेषित (synthesize) नहीं हो सकते, जैसे कि मीथेन, कार्बन डाइऑक्साइड, बेंजीन इत्यादि, इनका माप हेस के नियम से लिया जाता है।
- इससे ऊष्मा कि गति निर्धारित कि जाती है । योगिकों के बहुरूपी संशोधन जैसे कि हीरे से शीशा, रोम्बिक सल्फर से मोनोक्रोमिक सल्फर – इन सबकी ऊष्मा गति हेस के नियम के द्वारा निर्धारित कि जाती है।
- इस नियम के द्वारा प्रतिक्रिया के गठन (formation) में लगने वाली ऊष्मा को मापित किया जाता है।
- औद्योगिक जगत के लिए यह नियम काफी कारगर साबित हुआ है। ये ऐसे ईंधनों (जैसे कि बोरोन योगिक) के खोज में सहायक हैं जो सुक्ष्म मात्रा में भी अधिक ऊर्जा दे पाते हैं। इनके कारण आज हमारे अंतरिक्ष यान नए से नए खोज कर रहे हैं। इसके अलावा एल्युमीनियम ऑक्साइड का उत्पादन और रेल पटरियों के सुरक्षित निर्माण में भी ये काम आते हैं।
इस विषय से सम्बंधित आप अपने सवाल और सुझाव नीचे कमेंट में लिख सकते हैं।


thermochemistry aur thermophysics mein kya difference hai?
hess ke niyam ki wajah se kis cheez ki khoj ki jaa chuki hai yah important kyun hotaa hai?
Kosi prakriya me usma me Jo badlaav aata hai vah hamesha samaan kyo rehta hai yah prikriya ke samay badalta kyo nahi hai?